小分子biotech绝地求生:裁员50%,全力押注MASH创新疗法
MASH(代谢相关脂肪性肝炎,以前称为NASH/非酒精性脂肪性肝炎)曾经是新药研发“黑洞”一般的存在。由于MASH病因复杂、疾病异质性、缺乏明确的生物标志物、动物模型不完善等,许多潜在治疗方法在后期临床试验中未能证明其疗效或安全性,最后以失败告终。直到2024年全球首个针对MASH的创新药物Rezdiffra(Resmetirom)获批上市,这一领域才取得了根本性的突破。
MASH与肥胖、糖尿病等代谢性疾病密切相关,其治疗药物的研发也吸引了大量投资,包括来自大型制药公司的关注。现在有一家法国小分子biotech正将其全部精力和资源投入到MASH项目开发中,可以说是“背水一战”。
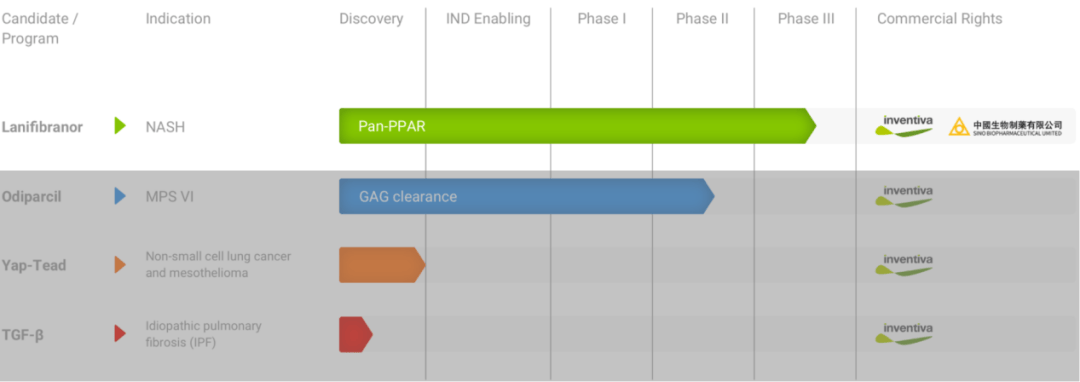
2025年2月10日,法国临床阶段生物制药公司Inventiva公布了战略调整计划,公司将专注于新型的口服小分子PPAR激动剂Lanifibranor的开发,并终止所有非Lanifibranor相关的临床前研究活动(包括YAP-TEAD抑制剂和NR4A1激动剂),同时扩大项目团队,为该候选药物MASH适应症的上市批准和随后的商业化做准备。这一战略调整将使该公司裁员约50%,预计将在2025年第二季度实施。根据公开信息,Inventiva拥有约90人的科学团队,因此估计这次裁员会涉及40多名员工。
其实早在2020年Inventiva就决定将开发重点放在Lanifibranor上面,当时公司还有一个早期临床项目Odiparcil,用于治疗粘多糖贮积症(MPS),后续公司可能寻求第三方合作伙伴来推动Odiparcil的开发和商业化。
Inventiva是一家通过管理层收购(MBO)从雅培/abbot独立出来的公司:Inventiva成立于2011年,联合创始人Frédéric Cren和Pierre Broqua博士分别担任公司CEO和CSO,这二人从法国制药公司Laboratoires Fournier开始共事至今已有20多年,Fournier于2005年被Solvay收购,Solvay的制药业务在2010年被雅培收购。2012年,Inventiva从雅培收购了前Solvay Pharmaceuticals研发中心资产后正式开始运营。2017年,Inventiva在巴黎泛欧证券交易所完成4850万欧元IPO。2020年,公司在美国纳斯达克全球市场以美国存托股份的形式完成二次IPO,筹集约1.077亿美元。
摩熵医药数据显示,Inventiva此次“孤注一掷”的Lanifibranor项目最早也是由Solvay研发。

药融云数据,www.pharnexcloud.com;改名后为摩熵医药数据
此前遭遇研发推迟、临床暂停
Lanifibranor被开发用于治疗成人MASH患者,目前正在开展名为NATiV3的关键3期临床试验。
NATiV3研究于2021年下半年启动,不过在2022年上半年,由于患者筛选失败率高于最初预期,导致入组速度低于预期,研究进度推迟。此外,新冠疫情以及持续的全球地缘政治事件也对研究进度造成影响。
2023年1月,该公司对NATiV3试验方案进行了部分修改,以加速患者入组,并确定了额外的试验中心,以弥补俄乌试验中心的影响。修订后的试验设计将计划的试验持续时间从原先的最长七年缩短至120周,同时将活检次数从三次减少到两次,并包括一项为期48周的阳性拓展临床试验。
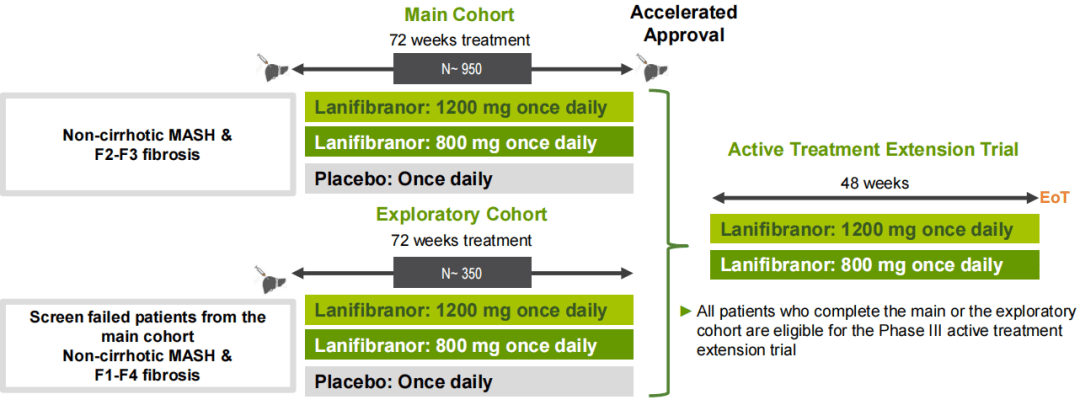
2024年2月15日,Inventiva披露在针对NATiV3研究的一次常规访问中,报告了一例可疑且非预期严重不良反应(SUSAR),即一名受试者出现转氨酶升高。这是Lanifibranor在所有临床研究中首次报告SUSAR。由于这一SUSAR事件,公司决定自愿暂停新的患者筛选和随机化入组,实施更改入组标准,排除那些诊断为自身免疫性肝病或甲状腺疾病或具有相关倾向的患者,并按照独立数据监测委员会(DMC)的建议,对参加试验的患者进行更频繁的肝脏监测。
2024年3月7日,该公司宣布在美国的中心机构审查委员会(IRB)监管下的临床试验站点已恢复患者筛选工作。
根据最新披露信息,NATiV3研究的患者筛选工作已在2025年1月初完成。超过95%的目标患者数量已完成随机分组,预计将在2025年上半年完成全部入组工作。NATiV3的总体结果预计将在2026年下半年公布。若进展顺利预计在2027年向美国FDA递交NDA申请。
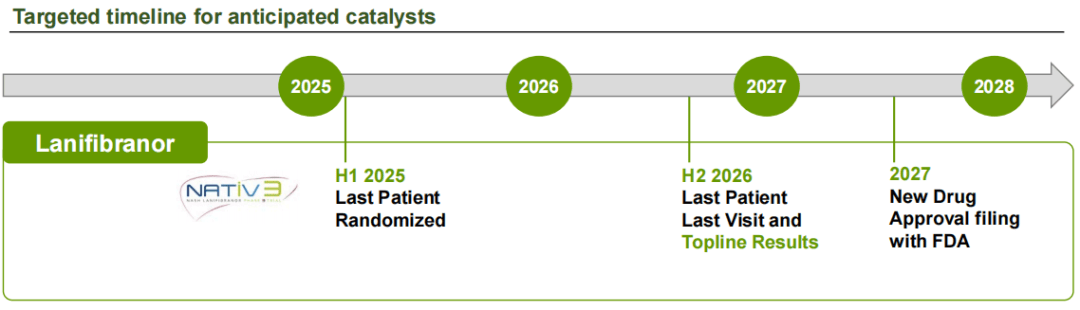
鉴于Madrigal Pharmaceuticals的THR-β激动剂Rezdiffra(Resmetirom)已在2024年获批用于治疗MASH,Inventiva目前对于Lanifibranor的商业定位是有望在2028年成为市场上第二种口服MASH药物,提供Best-in-class的纤维化、心血管和代谢益处。
PPAR激动剂进入肝病治疗领域
PPAR(过氧化物酶体增殖物激活受体)是一种被充分研究的核受体蛋白,能够调控基因表达,其在MASH/NASH相关的纤维化、炎症、血管和代谢过程中的重要性已被广泛证实。PPAR家族包含三种亚型:PPARα参与脂肪酸氧化、脂质代谢和炎症反应的调控;PPARγ参与脂肪细胞分化、胰岛素敏感性和葡萄糖代谢的调控;PPARβ/δ参与能量代谢、脂肪酸氧化和炎症反应的调控。
1999年,武田制药的PPARγ激动剂吡格列酮获美国FDA批准,用于治疗2型糖尿病,但其疑似的膀胱癌风险和心脏毒性副作用削弱了业内对于PPAR激动剂的认知。2008年,由于对葛兰素史克的PPARγ激动剂罗格列酮潜在心血管风险的关注,FDA实施了风险评估与缓解策略(REMS),以管理其使用并减少可能的风险。这再次给PPAR领域蒙上了阴影。到了2012年,基于新的证据,原先针对罗格列酮的安全性限制被移除,以及在2014年,新的荟萃分析显示吡格列酮与膀胱癌之间并没有关联,终于为PPAR靶点正名。
2024年,益普生的双重PPARα/δ激动剂Iqirvo(elafibranor)和吉利德的PPARδ激动剂Livdelzi(seladelpar)获FDA批准用于治疗原发性胆汁性胆管炎(PBC)这意味着PPAR激动剂正式扩展到了肝脏疾病治疗领域。特别是吉利德的Livdelzi(seladelpar)是来自于其在2024年2月以43亿美元收购的CymaBay Therapeutics,表明临床医生和工业界已经逐渐认识到PPAR激动剂的价值。

泛PPAR激动剂
与其他只靶向一种或两种PPAR亚型的PPAR激动剂有所不同,Inventiva的Lanifibranor是一种可激活PPAR的全部三种亚型的泛PPAR激动剂,在体内调节抗纤维化、抗炎症通路,有益于血管和代谢变化。据披露,Lanifibranor具有中效且均衡的泛PPAR激动剂活性,设计为每日口服1次,其化学结构既不同于贝特类药物(PPARα激动剂),也不同于噻唑烷二酮类化合物,是一种新化学实体,专利保护期可到2040年。
2020年6月,Inventiva宣布Lanifibranor在NASH患者的2b期NATIVE临床试验中获得的积极顶线结果。在这项试验中,1200 mg剂量的Lanifibranor治疗组,在24周后达到了减少炎症和肝细胞气球样变的主要终点,同时没有出现纤维化恶化,并继续显示出良好耐受性。该研究结果于2021年10月在《新英格兰医学杂志》发表。
由于以往的一些PPAR激动剂对心脏存在副作用,Inventiva还专门针对Lanifibranor开展了一项临床QT/QTc研究,用于评估该药对心脏复极化过程潜在影响,2021年12月,公司宣布该研究取得积极结果,表明Lanifibranor对QT/QTc间期没有影响。
2023年6月,Inventiva宣布了一项由研究者发起的2期临床试验的积极顶线结果,该试验评估了Lanifibranor在NAFLD(非酒精性脂肪肝病)和T2D(2型糖尿病)患者中的疗效。研究表明,与安慰剂组相比,使用质子磁共振波谱测量,Lanifibranor治疗组患者的肝内甘油三酯(IHTG)减少了44%,而安慰剂组仅减少了12%。研究还表明,与安慰剂相比,使用Lanifibranor治疗的患者中有更高比例的人实现了超过30%的肝脏甘油三酯减少(65% vs. 22%,p=0.008),以及NAFLD的缓解(定义为IHTG≤5.5%,25% vs. 0%,p=0.048)。
Inventiva还开展了一项名为LEGEND的2期概念验证性试验,该研究旨在评估Lanifibranor与SGLT2抑制剂恩格列净联合用于治疗非肝硬化性NASH和2型糖尿病患者的安全性和有效性。2024年3月,Inventiva宣布LEGEND研究获得积极结果,达到主要疗效终点:在第24周,接受Lanifibranor(每日800 mg)单药治疗或与恩格列净(每日10 mg)联合治疗的NASH和T2D患者的糖化血红蛋白绝对值分别下降了1.14%和1.59%,而安慰剂组则上升了0.26%。
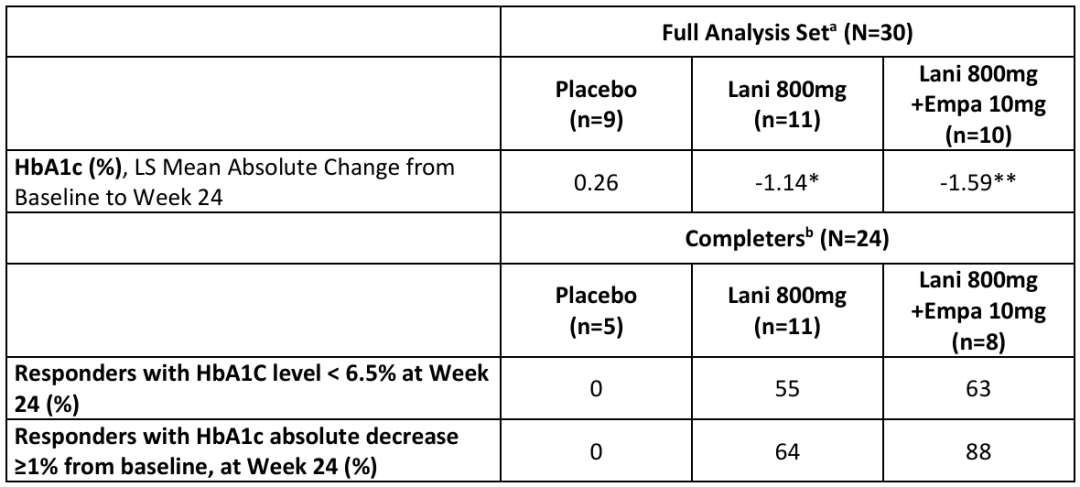
LEGEND研究还显示Lanifibranor单药治疗组与联合治疗组均使患者肝脂肪变性显著减少;肝脏炎症和纤维化显著改善;患者内脏脂肪和皮下脂肪组织比率降低。研究在多个次要和探索性终点上也显示出统计学显著效果,包括肝酶、高密度脂蛋白和脂联素。特别是联合治疗组患者在整个24周的研究期间体重保持稳定,解决了部分Lanifibranor单药治疗患者潜在的体重增加问题(PPARγ通路激活可能会导致体重增加)。
不过Inventiva并不寻求Lanifibranor与恩格列净联用的进一步开发,在获得这些概念验证之后,该公司便停止了LEGEND研究的患者招募工作,但可能会在未来的监管递交中提供该研究的安全性数据。
国内大厂合作,NewCo出海日韩
2022年9月,中国生物制药宣布集团附属公司正大天晴已与Inventiva公司签订正式许可协议,以在大中华区(中国大陆、香港、澳门、台湾地区)开发、生产并商业化Lanifibranor(拉尼兰诺),用于治疗NASH/MASH和潜在的其他代谢疾病。根据协议,正大天晴将向Inventiva支付1200万美元的预付款,及最高不超过4000万美元的潜在的临床及注册里程碑付款,以获得该产品在大中华区的独家许可。该产品在大中华区获批上市后,正大天晴将支付额外商业化里程碑付款及基于大中华区销售净额的分层提成。
2023年12月,Inventiva宣布合作伙伴正大天晴加入了关键3期临床试验NATiV3,完成了首个中国患者的随机化分组,并被NMPA授予治疗NASH的突破性疗法称号。据了解,Lanifibranor是国内首款开展NASH/MASH适应症3期研究的PPAR激动剂。
2023年9月,Inventiva与Hepalys Pharma宣布了一项在日本和韩国开发和商业化Lanifibranor的独家许可协议。Hepalys是由Catalys Pacific创立的一家NewCo,获得了包括Catalys Pacific、三菱日联资本(Mitsubishi UFJ Capital)、日本政策投资银行资本(DBJ Capital)以及MEDIPAL创新基金在内的知名投资者的支持。在Hepalys Pharma成立的同时,Inventiva行使其权利,获得了该公司30%的股权。也是一种newco。
根据许可协议,Inventiva于2023年10月获得了1000万美元的预付款,并有资格获得最高2.31亿美元里程碑付款;此外,基于Lanifibranor未来在日本和韩国潜在的净销售额,Inventiva还有望获得从中双位数到低二十几的比例的分层版税。
据披露,Hepalys将围绕Lanifibranor在日本患者和健康志愿者中进行两项1期临床试验,2025年2月已完成首个受试者给药。如果1期研究结果积极则有望支持Hepalys在日本和韩国NASH/MASH患者中启动一项专门的关键试验,不过这项关键试验需要等Inventiva的NATiV3研究获得结果之后才能启动。
现金流勉强撑到NDA
2024年10月,Inventiva宣布了一项多轮股权融资计划,初始融资金额为9410万欧元,在满足特定条件的情况下,最高融资金额可达3.48亿欧元。这笔资金将用于支持核心产品Lanifibranor完成针对MASH的关键3期试验NATiV3,并为其潜在市场批准申请及商业化做准备。
该轮融资由New Enterprise Associates、BVF Partners和Samsara BioCapital领投。根据本次交易,Inventiva将任命Mark Pruzanski博士为公司董事长,Srinivas Akkaraju博士为董事。其他四大投资者中的每一家将分别提名最多四名额外的董事,其中至少两人将符合独立董事资格,并将取代现有董事(不包括公司CEO Frédéric Cren)。
截至2024年12月底,Inventiva持有现金和现金等价物共9660万欧元。考虑到公司当前的成本结构和预计的支出,公司估计其现金及现金等价物足以支持运营至2025年第三季度中期。
Inventiva在2024年的收入主要来自于合作伙伴正大天晴的1000万美元(约为920万欧元)里程碑付款。全年R&D费用为9090万欧元,比2023年的1.1亿欧元下降了17%,主要是由于NATiV3研究报告了疑似意外严重不良反应后临时自愿暂停,其次是因为LEGEND试验的完成。随着下半年NATiV3研究重启患者招募,R&D费用再次增加。
在满足特定条件的情况下,Inventiva预计将在2025年第二季度获得来自结构化融资约1.16亿欧元的第二笔款项,以及从正大天晴获得1000万美元的第二笔里程碑付款。再结合此次战略调整计划,Inventiva估计现有的现金储备以及这些潜在的额外资金将足以支持其运营至2026年第三季度末。
截至3月27日收盘,该公司市值2.89亿美元。截止发稿前市值为3.37亿美元。
参考:
摩熵医药数据pharma.bcpmdata.com(原药融云数据);
Inventiva Pharma官网、幻灯片;
https://www.sinobiopharm.com/news-center/dynamic/24221.html;
https://www.globenewswire.com/news-release/2023/09/20/2746837/0/en/Inventiva-and-Hepalys-Pharma-Inc-announce-exclusive-licensing-agreement-to-develop-and-commercialize-lanifibranor-in-Japan-and-South-Korea.html;
https://www.globenewswire.com/news-release/2005/03/24/324926/669/en/Solvay-Signs-Agreement-Aiming-at-Acquisition-of-Fournier-Pharma.html;
其他相关公开信息(正文图片均来自企业官方,除非另有说明)。
此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场,不作任何用药推荐。更多药企信息交流可后台留下名片。
